TECHNOLOGY
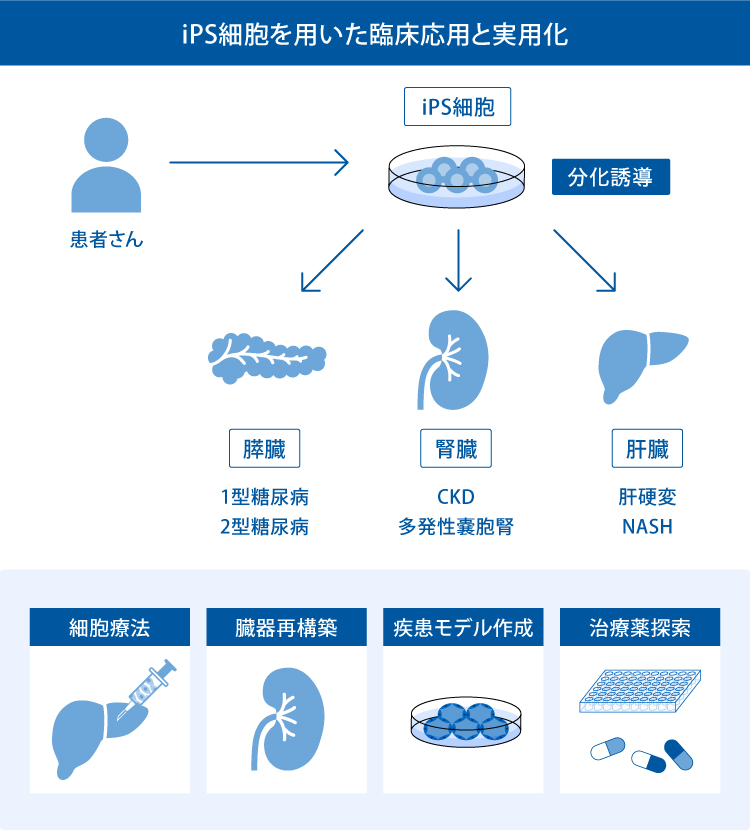
- I. iPS細胞を用いた研究技術
- 細胞療法
- ヒト病態モデル
- II. iPS細胞由来ネフロン前駆細胞による慢性腎臓病(CKD)の治療
- 細胞療法
- 腎組織再生
- 尿管芽
- 間質前駆細胞
- 臓器再生
- 再生腎移植
- 次世代ネフロン前駆細胞による細胞療法
- 低抗原iPS細胞
- 栄養因子強化細胞
- III. 常染色体優性(顕性)多発性嚢胞腎(ADPKD)病態モデルによる新規治療薬の探索
- ADPKD
- 新規治療薬の開発
- 創薬スクリーニング
- IV. 肝臓領域での研究
- iPS細胞由来肝細胞による肝硬変の細胞療法
- 非アルコール性脂肪肝炎(NASH)の病態モデルによる新規治療薬の探索
- シトリン欠損症の病態モデル
- V. 膵臓領域での研究
- iPS細胞由来次世代膵β細胞による細胞療法
- iPS細胞由来膵β細胞による創薬スクリーニング
I. iPS細胞を用いた研究技術
iPS細胞は、皮膚や血球などの細胞に特定の遺伝子を導入することで、全身の全ての細胞種への分化能と、ほぼ無限の増殖能を獲得した多能性の幹細胞です。 私たちは、iPS細胞を用いて腎臓、膵臓、肝臓領域の疾患の治療法を開発しています。
1. 細胞療法
iPS細胞から分化誘導した細胞を患者さんに移植し、疾患を治療します。
2. ヒト病態モデル
患者由来もしくは疾患に特異的なiPS細胞を分化誘導した細胞から構築した病態モデルから、新規の治療薬を探索します。
II. ヒトiPS細胞由来ネフロン前駆細胞による慢性腎臓病(CKD)の治療
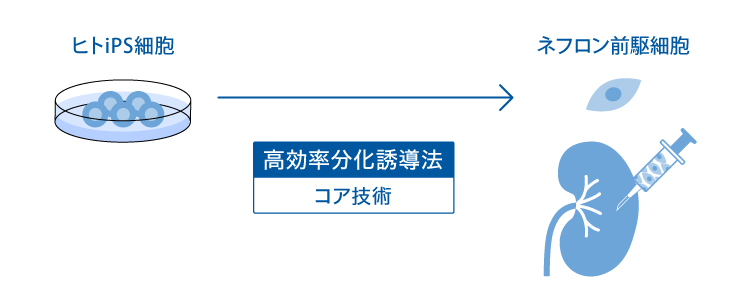
ネフロン前駆細胞は、私たちの科学顧問によって発見された、腎機能の最小単位であるネフロンの起源となる細胞です。 私たちの科学顧問のグループは、ヒトiPS細胞からネフロン前駆細胞を分化誘導することに成功しました。 私たちはネフロン前駆細胞を用いた複数のアプローチでCKDの治療法を開発しています。
CKDの患者さんは日本では1,300万人以上、毎年4万人以上が末期腎不全となり新たに透析療法を導入します。現在の透析人口は34万人を超えます。 その医療費は日本では約1.6兆円と全医療費の4%を占める医療経済的な負担の最も大きい疾患の一つです。しかし腎臓移植以外に根本的な治療法はありません。
1. 細胞療法
ヒトiPS細胞より作製したネフロン前駆細胞(1)による細胞療法が複数の腎疾患マウスモデルに効果があることが示されています(2-4)。 ネフロン前駆細胞の製剤化において課題であった細胞の凝集抑制技術の開発に成功しています(特許申請中)。 ヒトiPS細胞から作製したネフロン前駆細胞を投与する際に課題であった残存未分化iPS細胞の高感度検出系の開発にも成功しています(5)(特許申請中)。
1. Tsujimoto H, Kasahara T, Sueta S-I, Araoka T, Sakamoto S, Okada C, et al. A Modular Differentiation System Maps Multiple Human Kidney Lineages from Pluripotent Stem Cells. Cell Rep. 2020;31: 107476. doi:10.1016/j.celrep.2020.03.040 2. Toyohara T, Mae S-I, Sueta S-I, Inoue T, Yamagishi Y, Kawamoto T, et al. Cell Therapy Using Human Induced Pluripotent Stem Cell-Derived Renal Progenitors Ameliorates Acute Kidney Injury in Mice. Stem Cells Transl Med. 2015;4: 980–992. doi:10.5966/sctm.2014-0219 3. Hoshina A, Kawamoto T, Sueta S-I, Mae S-I, Araoka T, Tanaka H, et al. Development of new method to enrich human iPSC-derived renal progenitors using cell surface markers. Sci Rep. 2018;8: 6375. doi:10.1038/s41598-018-24714-3 4. 荒岡ら、弊社科学顧問のグループ、国際論文投稿中 5. Tsujimoto H, Katagiri N, Ijiri Y, Sasaki B, Kobayashi Y, Mima A, et al. In vitro methods to ensure absence of residual undifferentiated human induced pluripotent stem cells intermingled in induced nephron progenitor cells. Liu L-P, editor. PLoS One. 2022;17: e0275600. doi:10.1371/journal.pone.0275600
2. 腎組織再生
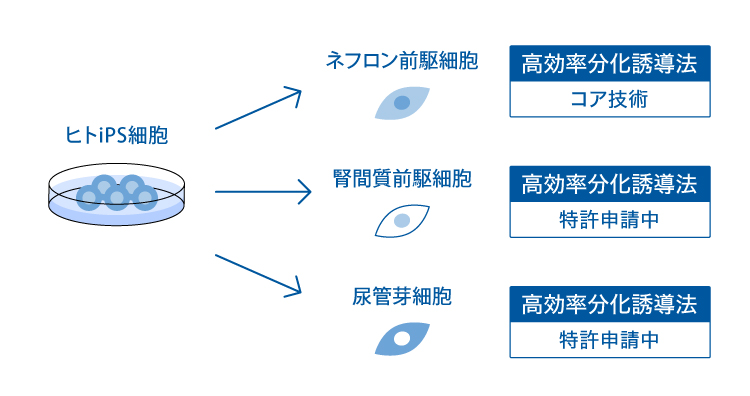
腎臓の胎児期の前駆細胞としてネフロン前駆細胞、腎間質前駆細胞、尿管芽細胞が知られています。 私たちの科学顧問のグループは、ヒトiPS細胞から集合管から膀胱の一部までの下部尿路を派生させる尿管芽組織を初めて高効率に分化誘導することに成功しました(6, 7)。 さらにヒトiPS細胞から腎臓組織の上皮細胞の支持組織を構成する細胞である腎間質の前駆細胞を高効率に分化誘導する技術を開発しました。 これらの技術を用いて英アストラゼネカ社と共同で腎臓組織を試験管内で再現し、治療法の開発に利用することを目指しています。
6. Mae SI, Ryosaka M, Sakamoto S, Matsuse K, Nozaki A, Igami M, et al. Expansion of Human iPSC-Derived Ureteric Bud Organoids with Repeated Branching Potential. Cell Rep. 2020;32. doi:10.1016/j.celrep.2020.107963 7. Mae S, Ryosaka M, Toyoda T, Matsuse K, Oshima Y, Tsujimoto H, et al. Generation of branching ureteric bud tissues from human pluripotent stem cells. Biochem Biophys Res Commun. 2017; 1–8. doi:10.1016/j.bbrc.2017.11.105
3. 臓器再生
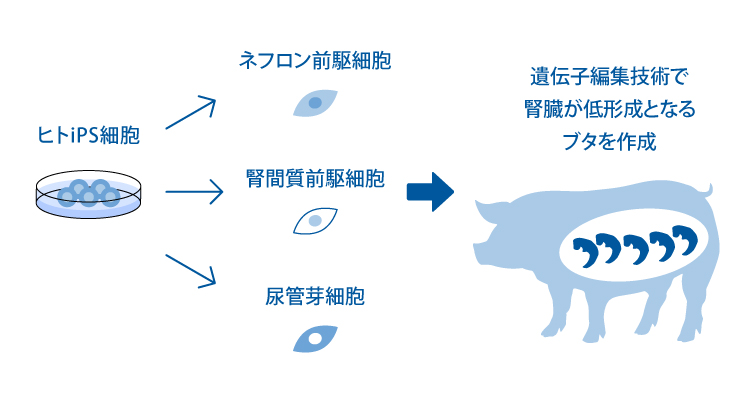
私たちはクローンブタ生産、遺伝子改変ブタ作製技術を有するポル・メド・テック社と共同で、腎臓が低形成となるブタの開発を行っています。 ヒトiPS細胞から作製した腎臓の前駆細胞を腎臓が低形成となるブタの子宮内に移植し、臓器としての腎臓を子宮内で再構築することで、ヒト細胞由来の腎臓をブタの体内で作製することを目指しています。
4.次世代ネフロン前駆細胞による細胞療法
i. 低抗原iPS株
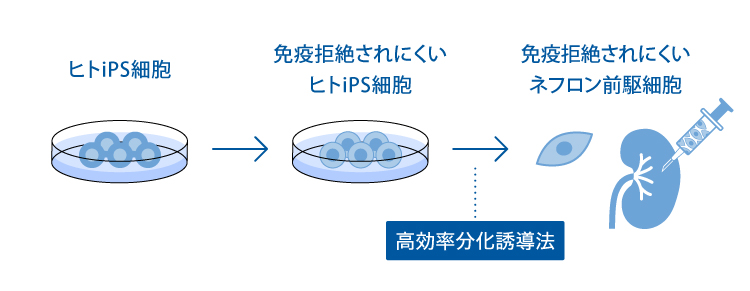
私たちの科学顧問のグループは、iPS細胞財団と共同でより長期間生存し、幅広い患者様が利用できるネフロン前駆細胞を開発するために、さらにHLAゲノム編集iPS細胞を用いて免疫拒絶されにくいネフロン前駆細胞の開発も行っています。
ii. 栄養因子強化細胞
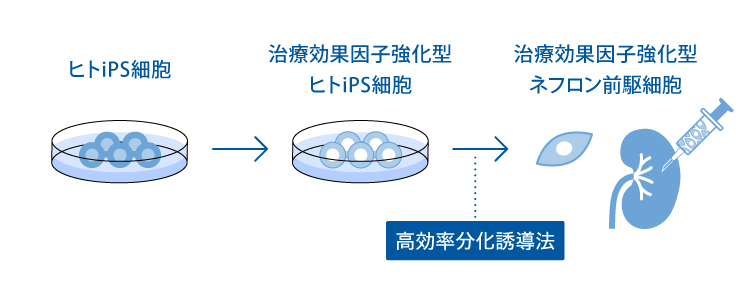
私たちの科学顧問のグループは、ネフロン前駆細胞の薬効が細胞から分泌される栄養因子が近接する細胞に作用するパラクライン効果によることを同定しています(2, 4)。 その薬効因子をより強く発現させるiPS細胞を用いて、治療効果増強型ネフロン前駆細胞も開発しています。
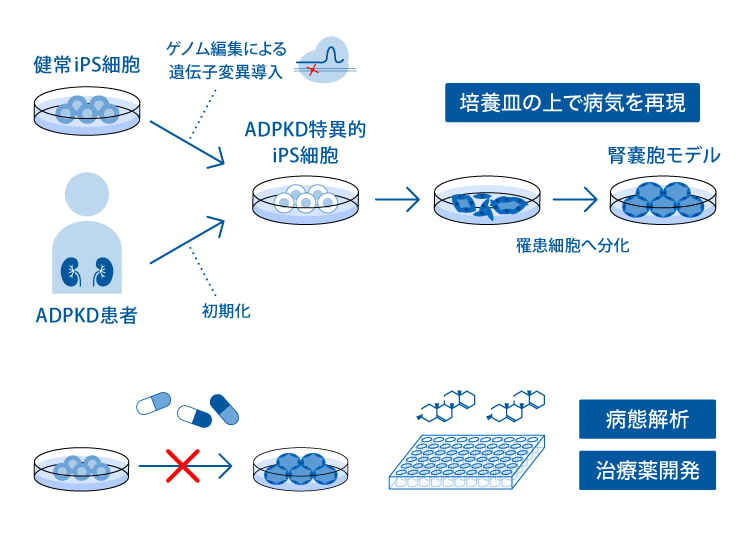
III. 常染色体優性(顕性)多発性嚢胞腎(ADPKD)病態モデルによる新規治療薬の探索
1. ADPKD
ADPKDは最も患者数の多い遺伝性腎疾患であり、腎臓に多数の囊胞(液体のたまった袋)が多発し徐々に増大することで腎機能低下が進行し、70歳までに約半数の患者さんが透析や腎移植を必要とする末期腎不全に至ります。 近年、嚢胞の増大を抑制するトルバプタンという薬剤が治療に用いられていますが、根治的治療法は未だ開発されていません。
私たちは、ゲノム編集技術を用いてADPKDの原因遺伝子であるPKD1遺伝子に変異を持つヒトiPS細胞を作製し分化誘導することで、ADPKDの症状を再現した腎オルガノイド(三次元的に臓器の一部を再現したもの)を作製する技術を有しています。
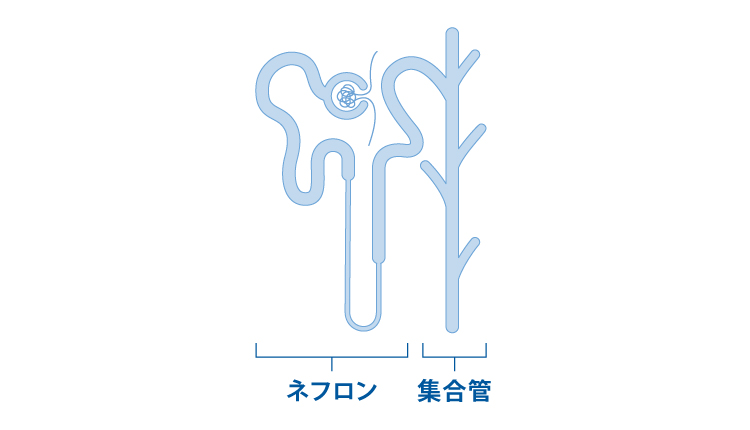
これまで、遺伝子編集を行ったヒトiPS細胞を用いて、腎臓のネフロンという尿を生成する組織の疾患モデルが作製されていましたが、私たちの科学顧問のグループは、ネフロンと連結している集合管と呼ばれる構造の疾患モデルを作製することに成功しました(1)。ADPKDの患者さんでは、集合管に多く嚢胞が発生しており、新しい疾患モデルではより正確にADPKDの病態を再現することができるようになりました。
1.Shin-Ichi Mae, et al. “Human iPSC-derived renal collecting duct organoid model cystogenesis in ADPKD” Cell Reports, 2023
2. 新規治療薬の開発
ADPKDの嚢胞を再現した腎オルガノイドを使って、新規の治療薬候補としてレチノイン酸受容体(RAR)作動薬を同定し、2023年12月より臨床試験を開始しています。
3. 創薬スクリーニング
さらにこの病態モデルを用いて、自動化技術を搭載したハイスループットスクリーニングを行うことで、何万種類もの化合物から高効率に新規治療薬となりうる薬剤を選出します。
IV. 肝臓領域での研究
1. iPS由来肝細胞による肝硬変の細胞療法
肝硬変とは、非アルコール性脂肪肝炎(NASH)などの慢性肝炎により肝細胞が破壊され、線維化や結節の形成が進行して、肝臓が硬化・縮小する疾患です。肝がんの原因となるだけでなく重篤な症状や合併症が多く、日本では年に約17,000人が亡くなります。 私たちの科学顧問のグループは、ヒトiPS細胞から肝硬変に対する治療効果の高い肝細胞を分化誘導することに成功し、新しい肝硬変の治療法として開発しています。
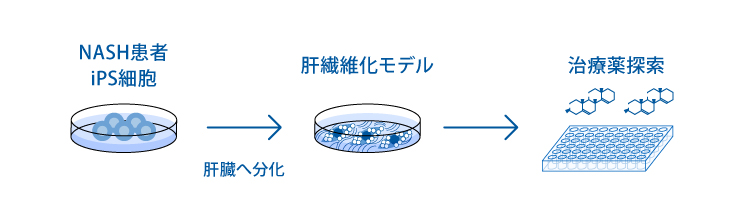
2. 非アルコール性脂肪肝炎(NASH)の病態モデルによる新規治療薬の開発
脂肪肝とは肝臓に中性脂肪が蓄積した状態で、肝炎のみならず肝硬変や肝がんに至る場合があります。以前はアルコールによる脂肪肝が主体でしたが、近年、生活習慣の悪化からアルコールを多飲しない人に起こる肝炎であるNASHの発症率が高まっており、早急な治療薬の開発が求められています。 私たちはNASHによる肝臓の線維化を抑制する薬を開発しています。
NASH患者さんより樹立したiPS細胞より肝オルガノイドを分化誘導 (病態モデルの作製) ↓ ハイスループットスクリーニングを行い、繊維化を抑制する新規治療薬を開発
3. シトリン欠損症の病態モデル
シトリン欠損症(成人発症Ⅱ型シトルリン血症)は、高アンモニア血症、高シトルリン血症を起こし、精神症状のほか肝不全を起こす重篤な疾患です。発症率は本邦では1/17,000人ほどで、決して稀ではない疾患です。 原因遺伝子としてSLC25A13が同定され、その遺伝子産物であるシトリンは肝臓のミトコンドリア内膜に存在し代謝に関わることから肝臓移植が奏功しますが、ドナーの不足からも治療薬の開発が求められています。私たちは、シトリン欠損症のヒト病態モデルを開発しました。
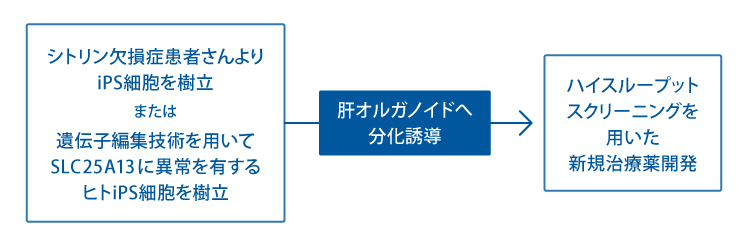
また、肝不全に至った場合にNASHを呈することから、シトリン欠損症の新規治療薬はNASHの治療薬として有用になる可能性があります。
V. 膵臓領域での研究
糖尿病は、膵臓にあるインスリンを分泌する膵β細胞の機能不全により生じ、高血糖が続くことで動脈硬化を促進し、CKDや脳梗塞、心筋梗塞を引き起こします。 私たちは糖尿病に対し、1. 次世代細胞療法 と、2. 創薬スクリーニング による新規治療薬の開発を行っています。
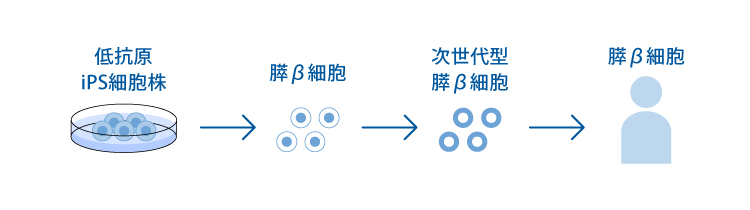
1. 次世代細胞療法
<低抗原性iPS細胞を用いた膵β細胞の移植>
拒絶反応リスクの少ない低抗原性のiPS細胞を用いて、膵β細胞を作製し移植します。移植時の拒絶反応を抑えることで、移植細胞の生着率や機能の向上が期待できるほか、患者さんが服用する免疫抑制剤の量が低減されることが期待されます。
2. 創薬スクリーニング
<iPS細胞由来膵β細胞を用いたハイスループットスクリーニング>
iPS細胞から作製した膵β細胞を用いて治療薬候補をスクリーニングし、新規治療薬を探索します。自動化技術によるハイスループットスクリーニングを行うことで、何万種類もの化合物から有用なものを高効率で選出します。